2020-04-27来源:中国青年报客户端
中国青年报客户端北京4月27日电(中青报·中青网记者
邱晨辉)备受关注的中国原创阿尔茨海默病新药“九期一”迎来了最新进展。据绿谷制药官网今天的消息,美国食品药品监督管理局(FDA)近日批准了其在美国开展国际多中心Ⅲ期临床试验的申请,该注册自4月3日起正式生效。

阿尔茨海默病是一种神经退行性脑部疾病,发病机制十分复杂,病程时间长。统计显示,目前全球阿尔茨海默病患者高达5000万人,中国患者约占20%,其治疗被认为是世界性难题。
“九期一”是由中国科学院上海药物研究所耿美玉研究员领导研究团队,坚持22年,在中国海洋大学、中国科学院上海药物研究所与上海绿谷制药有限公司接续努力研发成功的原创新药。

2019年11月,中国国家药品监督管理局有条件批准“九期一”上市,“用于轻度至中度阿尔茨海默病,改善患者认知功能”。

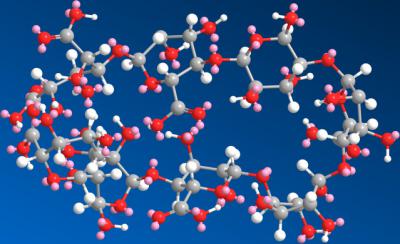
图为“九期一”化学结构式
这也是自2003年以来全球第一个被批准的治疗阿尔茨海默病新药。绿谷制药以“九期一”在中国国内的Ⅲ期临床试验为数据基础,直接向FDA申请开展国际多中心Ⅲ期临床试验并获得批准,缩短了药物上市进程。
据绿谷制药此前发布的消息,“九期一”国际多中心Ⅲ期临床试验计划,将由美国克利夫兰医学中心教授杰弗里·卡明斯主导临床试验方案设计并担任科学决策委员会主席,全球最大医药临床试验业务公司艾昆纬负责临床试验管理。
因受新冠肺炎疫情影响,“九期一”国际多中心Ⅲ期临床试验将比原计划晚些启动。绿谷制药首席执行官任政杰表示:“新冠肺炎疫情短期内对临床试验肯定有影响。但长期来看,不会有太大影响。”
根据最新的临床试验方案,该项研究计划将在北美、欧盟、东欧、亚太等12个国家及中国香港和中国台湾地区的200个临床中心,超过2000名的轻、中度阿尔茨海默病患者中开展为期12个月的双盲试验和随后6个月的开放试验。整个临床研究将跳过Ⅰ期、Ⅱ期,直接进入国际Ⅲ期临床试验,预计2024年完成,2025年提交新药申请。